摘要:此前,万邦德已在 2024 年 4 月底和 5 月底分别获 FDA 授予石杉碱甲治疗新生儿 HIE 的罕见儿科疾病用药认定(RPDD)与孤儿药认定(ODD)。
①目前美国尚无石杉碱甲药品获批上市,且全球尚无获批药物用于治疗新生儿HIE。
②多项临床前研究显示,WP103 治疗新生儿HIE潜力较大,有望通过综合作用机制为患儿带来显著的临床获益。
③按美国每年近万名新生儿发病,石杉碱甲若治疗 5000 患儿,按 20 万美元/患儿/疗程预计费用,WP103 年销售额有望达 10 亿美元。

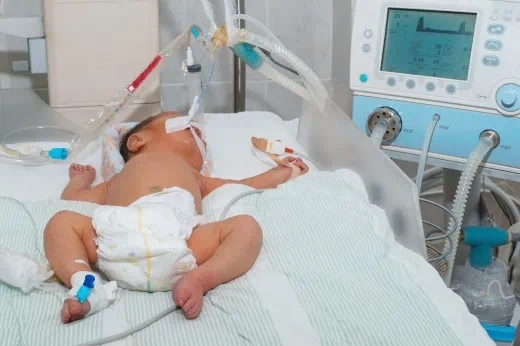
美国东部时间 12 月 17 日,万邦德制药集团研发的创新药新石杉碱甲注射液(WP103)针对新生儿缺氧缺血性脑病(HIE)新适应症的临床试验(IND)申请,获美国食品药品监督管理局(FDA)受理并进入专业审评阶段。这一进展意义重大,不仅将为全球新生儿 HIE 治疗开拓新路径,更是万邦德在创新药研发与全球市场布局的关键里程碑。
HIE 是由新生儿脑组织缺氧和脑血流量减少引起的严重脑损伤疾病,对发育中的大脑影响极大,是导致新生儿死亡和残疾的重要原因之一。在美国,每年约有近10,000 名婴儿受其影响;全球范围内,每年更是约有 75 万婴儿罹患中度或重度 HIE,其中约 40 万婴儿会因此患有神经发育障碍。
WP103 多项临床前研究表明,在治疗新生儿 HIE 方面具有巨大潜力。它能够通过综合的作用机制,为患儿带来显著的临床获益;且具备安全性好、室温可保存、有效期长等优势,一旦获批即成为唯一 FDA 认可的新生儿 HIE 治疗药物。按美国每年近10000名新生儿发病,若治疗 5000 患儿,预计疗程费用 20 万美元/患儿计算,万邦德WP103 年销售额有望达 10 亿美元,即有望成为继百济神州泽布替尼后的中国首创第二款“重磅炸弹药”(国际上一般将年销售达到10亿美元的药品称为“重磅炸弹药”)。
此前,万邦德已在 2024 年 4 月底和 5 月底分别获 FDA 授予石杉碱甲治疗新生儿 HIE 的罕见儿科疾病用药认定(RPDD)与孤儿药认定(ODD)。作为全球少有的获 FDA 双认定药品,WP103 享有 7 年市场专营权、新药申请优先审评审批、注册费用免除及更多 FDA 指导支持等,将有力推动儿科罕见病药物研发进程,其商业、医学与社会价值备受全球瞩目( 据悉澳大利亚Neuren制药的trofinetide,针对Rett syndrome这一罕见病适应症,通过权益转让,实现约10亿美元的转让收益,而Rett syndrome在美国仅有大约6000-9000患者)。